Los éteres son compuestos químicos formados por carbono, hidrógeno y oxígeno. Un éter consiste en un átomo de oxigeno que está unido mediante enlaces sencillos a los átomos de carbono que forman parte de grupos alquilo o aromáticos. El más sencillo de los éteres es el dimetil éter, llamado también metoximetano.
Dimetil éter: CH3-O-CH3
En este artículo, encontrarás:
Propiedades de los éteres
Los éteres son compuestos orgánicos que se caracterizan por una serie de propiedades:
- Solubilidad
- Alta volatilidad
- Reactividad
- Inflamabilidad
Solubilidad
La solubilidad es la capacidad de las sustancias de combinarse físicamente con otras. Los éteres son solubles en agua en diferentes proporciones. El éter etílico (etoxietano) forma mezclas con agua en distintas cantidades. Este y el éter metílico (metoximetano) son los más miscibles con agua. Esto se debe a que sus moléculas se encuentran con sus cadenas bien balanceadas.
Alta volatilidad
Los éteres son muy volátiles; es decir, tienen puntos de ebullición menores al del agua. Esto provoca que se conviertan en vapor muy fácilmente. En ocasiones es un problema, porque las grandes cantidades de vapores a temperatura ambiente tienen el peligro de inflamarse ante la menor chispa.

Reactividad
Los éteres, al involucrarse en reacciones químicas, son capaces de desprenderse de una de sus cadenas laterales, de grupo alquilo. Esta cadena podrá unirse a aniones como los halógenos (Cl–, Br–) (I–), que son los elementos más electronegativos. El resto de la molécula del éter se unirá a un átomo de hidrógeno para completarse, formando un alcohol.
[CH3 – CH2 – O – CH2 – CH3]+ HCl –> [CH3 – CH2 – Cl] + [CH3 – CH2 – OH]
Inflamabilidad
La inflamabilidad es la propiedad química de las sustancias en la que, al presentarse una chispa, entran en una reacción de combustión, emitiendo una cantidad de calor y descomponiéndose en dióxido de carbono y agua. Los éteres son inflamables, sobre todo por su alta volatilidad. El etoxietano o dietil éter es peligroso porque su flama es transparente, y es difícil notar su reacción.
Nomenclatura de los éteres
En el nombre común de un éter, los nombres de los grupos alquilo o aromáticos unidos al átomo de oxigeno se escriben en orden alfabético, sin la terminación o, seguidos de la palabra éter.
Ejemplo 1:
CH3 – O – CH2 – CH2 – CH3
Metil – O – Propil
Nombre común: metil propil éter
En el sistema IUPAC, para nombrar un éter se utiliza un grupo alcoxi constituido por el grupo alquilo más pequeño y el átomo de oxígeno, seguido por el nombre del alcano de la cadena de carbono más larga.
Ejemplo:
CH3 – O – CH2 – CH2 – CH3
Metil – O – Propil
Nombre IUPAC: 1-metoxipropano
Usos de los éteres
Los éteres son compuestos químicos sumamente útiles en el campo de la anestesiología. La anestesia es la pérdida de toda sensibilidad y conciencia. Un anestésico general es una sustancia que bloquea las señales hacia los centros de la conciencia en el cerebro, de modo que la persona experimenta una pérdida de memoria y de la sensibilidad al dolor, y un sueño artificial.
El dietil éter, también llamado éter etílico, fue el anestésico que más se utilizó durante más de 100 años. Aunque es sencillo de administrar, el éter es muy volátil y altamente inflamable. Una pequeña chispa en el quirófano podría causar una explosión. Desde la década de 1950 se desarrollaron anestésicos que no son inflamables, como forano, etrano, y pentrano.
- Forano (isoflurano): CF3 – CHCl – O – CHF2
- Etrano (enflurano): CHF2 – O – CF2 – CHFCl
- Pentrano (metoxiflurano): CHCl2 – CF2 – O – CH3
La mayor parte de estos anestésicos conservan el grupo éter, pero la adición de muchos átomos de halógeno reduce la volatilidad y la inflamabilidad de los éteres. En tiempos recientes, se sustituyen con Fluotano (halotano)(2-bromo-2-cloro-1,1,1-trifluoroetano): CF3-CHBrCl.
Ejemplos de éteres
- Dimetil éter o metoximetano: CH3 – O – CH3
- Metil etil éter o metoxietano: CH3 – O – CH2 – CH3
- Metil propil éter o metoxipropano: CH3 – O – CH2 – CH2 – CH3
- Metil butil éter o metoxibutano: CH3 – O – CH2 – CH2 – CH2 – CH3
- Dietil éter o etoxietano: CH3 – CH2 – O – CH2 – CH3
- Etil propil éter o etoxipropano: CH3 – CH2 – O – CH2 – CH2 – CH3
- Etilbutil éter o etoxibutano: CH3 – CH2 – O – CH2 – CH2 – CH2 – CH3
- Dipropil éter o propoxipropano: CH3 – CH2 – CH2 – O – CH2 – CH2 – CH3
- Propilbutil éter o propoxibutano: CH3 – CH2 – CH2 – O – CH2 – CH2 – CH2 – CH3
- Dibutil éter o butoxibutano: CH3 – CH2 – CH2 – CH2 – O – CH2 – CH2 – CH2 – CH3
- Metilfenil éter o metoxibenceno: CH3 – O – C6H5
- Etilfenil éter o etoxibenceno: CH3 – CH2 – O – C6H5
- Propilfenil éter o propoxibenceno: CH3 – CH2 – CH2 – O – C6H5
- Butilfenil éter o butoxibenceno: CH3 – CH2 – CH2 – CH2 – O – C6H5
- Pentilfenil éter o pentoxibenceno: CH3 – CH2 – CH2 – CH2 – CH2 – O – C6H5
- Hexilfenil éter o hexoxibenceno: CH3 – CH2 – CH2 – CH2 – CH2 – CH2 – O – C6H5
- Difenil éter o fenoxibenceno: C6H5 – O – C6H5
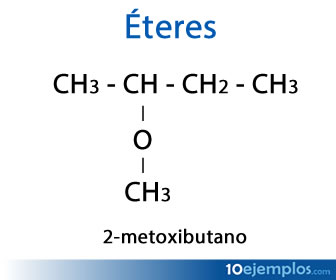
- 2-metoxibutano: CH3 – CH ( – O – CH3) – CH2 – CH3 (el paréntesis indica que la cadena se coloca hacia abajo).
- 2-etoxibutano: CH3 – CH ( – O – CH2 – CH3) – CH2 – CH3 (el paréntesis indica que la cadena se coloca hacia abajo).
- 3-metoxipentano: CH3 – CH2 – CH ( – O – CH3) – CH2 – CH3 (el paréntesis indica que la cadena se coloca hacia abajo).
- 3-etoxipentano: CH3 – CH2 – CH ( – O – CH2 – CH3) – CH2 – CH3 (el paréntesis indica que la cadena se coloca hacia abajo).